塩化ナトリウム
NaCl Mw=58.44
CAS 7647-14-5


いうまでもなく食塩です。
中学理科どころか小学校でも登場しますが、そもそも家にある「しお」です。
中学理科では1年では、溶解度の違いによる再結晶の実験で、温度によって溶解度がほとんど変化しないので再結晶がうまくいかなので蒸発乾固で結晶をとりだしますとかやりましたね。
2年では分子をつくらない物質の例として、3年では結晶の食塩は電流を通さないけど食塩水は電流を通すとか、塩酸と水酸化ナトリウムの中和でできる塩として登場頻度が多い物質です。
それから岩塩も塩化ナトリウムですね。


なんせ食塩なので、SDSにもこれといったことは書かれていません。
しょうがないので、濃硫酸に食塩を加えると塩化水素ができると書いておきましょう。
NaCl + H2SO4 → NaHSO4 + HCl
過去には溶解度に関するマニアックなデータ比較なんかもしましたね。
ところで最近は、普通の食塩は、コンビニには意外においてないんですよ。「●●の塩」みたいなのしか売ってないんです。値段もシンプルな食塩より高いし(その分、店の利益も大きいのかな)。ちなみに食塩と並んでマッチも、理科の実験でよく使うのに、巷の店ではあまり売ってなくて入手に何気に困った経験があります。
食塩の袋のデザインが2014年のあたりで変わったようです。左が新しいやつ、右が古いやつ。新しい方には竜宮城の乙姫様みたいなキャラクターが描かれています。塩事業センターのサイトを見てみると、そるるんひめというらしいです。

それと新たな発見。どこの海水で作られた塩か袋に書いてあるのね。新しいのは徳島県鳴門市、古いのは兵庫県赤穂市ということです。他の場所含めてこんなところで作られています。

硫酸ナトリウム
硫酸ナトリウム は無水と十水和物があります。
無水 Na2SO4 Mw=142.04 CAS RN® 7757-82-6
十水和物 Na2SO4・10H2O Mw=322.19 CAS RN® 7727-73-3
無水は吸湿性が強く、有機合成などでは乾燥剤として使われます。
十水和物は芒硝(ぼうしょう)あるいはグラウバー塩ともいわれ、空気中に放置すると結晶水を失って徐々に無水物になる風解性があります。
また、32.4℃で結晶水に溶解します(これについては後述します)。
高杉製薬の硫酸ナトリウムについての製品情報も見ておきましょう。
そして、硫酸ナトリウムで特筆すべき点といえば溶解度。次の図の紫のグラフがそれです。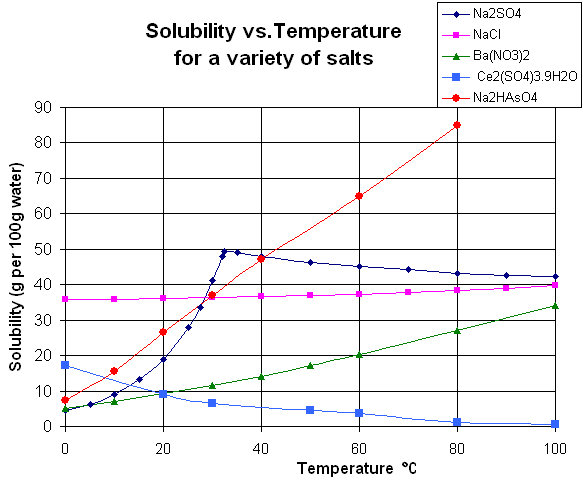 wikimediaより
wikimediaより
32.4 ℃を境に折れ曲がっています。この温度より低い温度で水溶液を濃縮すると10水和物が析出し、高い温度だと無水物が析出します。先ほどの十水和物が「32.4℃で結晶水に溶解します」というのは32℃以上だと硫酸ナトリウム自体が無水になるので、それまで結晶水だった水が、単なる溶媒の水として働くということです(結晶水でも水溶液になれば溶媒の水ですが…)。
ちなみにこの硫酸ナトリウムの溶解度のグラフについては2016年に東大の入試で出題されています。


コメント